La Teoría de Colisiones: Fundamentos y Aplicaciones
La teoría de colisiones es uno de los pilares fundamentales para entender los procesos cinéticos en la química y la física, especialmente en el contexto de las reacciones químicas y la física de partículas. Esta teoría proporciona una descripción detallada de cómo las moléculas interactúan entre sí durante una reacción, permitiendo que los científicos modelen y predigan cómo se comportan las sustancias en diversas condiciones. A lo largo de este artículo, exploraremos los principios fundamentales de la teoría de colisiones, sus aplicaciones en diferentes áreas de la ciencia, y cómo su comprensión ha avanzado con el tiempo.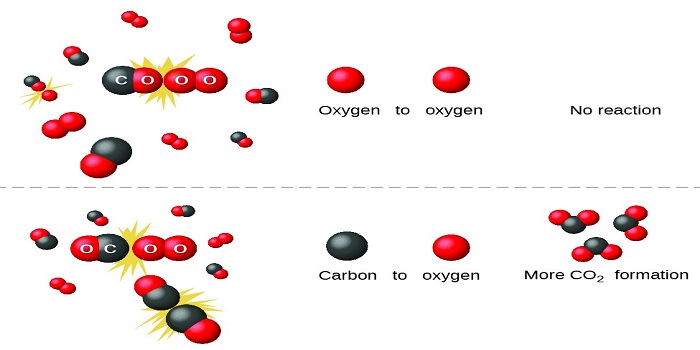

Origen y Desarrollo de la Teoría de Colisiones
La teoría de colisiones fue desarrollada a fines del siglo XIX, cuando los químicos comenzaron a estudiar cómo las moléculas de las sustancias reaccionan entre sí bajo distintas condiciones. En sus primeras formulaciones, se centraba en la idea de que las moléculas de los reactivos debían chocar con suficiente energía y orientación adecuada para que ocurriera una reacción química.
Esta teoría se basaba en el concepto de que la tasa de una reacción química no solo depende de la concentración de las sustancias reaccionantes, sino también de la frecuencia y la energía de los choques moleculares. El concepto de «colisión efectiva» fue introducido para describir aquellos choques que resultan en una reacción exitosa, es decir, aquellos que tienen suficiente energía para superar la barrera de activación.
Principios Fundamentales de la Teoría de Colisiones
1. Colisiones entre moléculas
Las moléculas en un sistema se encuentran en constante movimiento debido a su energía cinética. Según la teoría de colisiones, para que se produzca una reacción química, las moléculas de los reactivos deben chocar entre sí. No todas las colisiones dan como resultado una reacción, ya que no todas poseen las características necesarias para que los átomos en las moléculas puedan reorganizarse y formar nuevos productos.
2. Energía de activación
La energía de activación es la cantidad mínima de energía que deben tener las moléculas al momento del choque para que se rompan los enlaces existentes y se formen nuevos. Este concepto es clave en la teoría de colisiones, ya que sin suficiente energía para superar esta barrera, las moléculas simplemente se repelen o rebotan sin producir una reacción química.
3. Orientación de las moléculas
Además de la energía, las moléculas deben estar orientadas de manera adecuada para que la colisión sea efectiva. Las moléculas tienen formas y estructuras específicas que afectan cómo interactúan entre sí. Si los reactivos no se encuentran en la orientación adecuada, aunque tengan suficiente energía, la colisión no resultará en una reacción química exitosa.
4. Frecuencia de colisiones
La frecuencia de las colisiones también juega un papel importante en la velocidad de la reacción. A mayor número de colisiones entre las moléculas, mayor es la probabilidad de que se produzcan colisiones efectivas. Este principio está relacionado con la concentración de los reactivos: cuanto mayor es la concentración de una sustancia, mayor es la probabilidad de que las moléculas colisionen.
La Relación entre la Teoría de Colisiones y la Velocidad de Reacción
Uno de los aspectos más interesantes de la teoría de colisiones es su capacidad para explicar la velocidad de las reacciones químicas. La velocidad de una reacción química es el número de colisiones efectivas por unidad de tiempo. Según la teoría de colisiones, esta velocidad depende de varios factores:
- Concentración de los reactivos: A medida que aumenta la concentración de los reactivos, aumenta la probabilidad de que las moléculas colisionen entre sí, lo que generalmente resulta en una mayor velocidad de reacción.
- Temperatura: Al elevar la temperatura, las moléculas adquieren más energía cinética, lo que aumenta la frecuencia de las colisiones y la probabilidad de que sean efectivas.
- Presencia de catalizadores: Los catalizadores actúan reduciendo la energía de activación necesaria para que ocurra una reacción, lo que incrementa la velocidad de las reacciones sin ser consumidos en el proceso.
En este contexto, la teoría de colisiones se complementa con la ecuación de Arrhenius, que describe la relación matemática entre la velocidad de reacción y la temperatura, incluyendo el concepto de energía de activación.
Aplicaciones de la Teoría de Colisiones
La teoría de colisiones no solo tiene importancia en la química, sino también en otros campos de la ciencia y la ingeniería. Entre sus principales aplicaciones se encuentran:
1. Química y Catálisis
En química, la teoría de colisiones es crucial para entender cómo se producen las reacciones químicas a nivel molecular. Permite predecir cómo factores como la temperatura, la concentración y el uso de catalizadores pueden influir en la velocidad de una reacción. Esto es fundamental en la industria química, donde la optimización de las condiciones de reacción es clave para la producción eficiente de productos químicos.
Por ejemplo, los catalizadores en los motores de los automóviles funcionan al reducir la energía de activación necesaria para que los productos contaminantes se transformen en compuestos menos dañinos. De manera similar, en la industria farmacéutica, los catalizadores pueden hacer más eficientes los procesos de síntesis de medicamentos.
2. Física de Partículas
En la física de partículas, la teoría de colisiones es fundamental para entender los procesos de interacción entre partículas subatómicas. En aceleradores de partículas como el CERN, se producen colisiones entre partículas a altísimas velocidades, lo que permite a los científicos estudiar las fuerzas fundamentales de la naturaleza y las partículas elementales. Aunque las colisiones en física de partículas son mucho más complejas que en la química, el principio básico de que las partículas deben interactuar para producir un resultado sigue siendo el mismo.
3. Modelado de Reacciones en Medio Biológico
La teoría de colisiones también tiene aplicaciones en la bioquímica. Las enzimas, como catalizadores biológicos, facilitan las reacciones químicas dentro de los organismos. Estas reacciones están profundamente influenciadas por la frecuencia de las colisiones entre las moléculas del sustrato y las enzimas. Además, los estudios sobre cómo las condiciones ambientales (como el pH o la temperatura) afectan la eficacia de las enzimas pueden modelarse utilizando los principios de la teoría de colisiones.
4. Ingeniería Química y Procesos Industriales
La ingeniería química utiliza la teoría de colisiones para diseñar y optimizar procesos industriales, como la producción de productos químicos, combustibles o materiales. El control de la temperatura, la presión y la concentración de reactivos en los reactores industriales tiene como base estos principios. De igual manera, el estudio de la cinética de reacciones es esencial para el diseño de sistemas de control de procesos eficientes.
Avances Recientes y Desafíos en la Teoría de Colisiones
Aunque la teoría de colisiones ha sido una herramienta poderosa en la ciencia, los avances recientes en física y química han desafiado algunos de sus principios. La comprensión de las interacciones moleculares ha progresado, y se ha demostrado que muchos procesos químicos ocurren a una velocidad mucho mayor de lo que la teoría tradicional podría prever, gracias a fenómenos cuánticos y efectos a nivel subatómico.
En la actualidad, la teoría de colisiones se complementa con otros enfoques más avanzados, como la teoría de redes de reacciones y la simulación molecular. Estas nuevas perspectivas permiten modelar las reacciones con una precisión aún mayor, considerando factores como las interacciones no lineales entre moléculas y el impacto de los solventes en las reacciones.
Conclusión
La teoría de colisiones ha sido un concepto central en el estudio de la química y la física durante más de un siglo. Su capacidad para explicar cómo las moléculas interactúan y cómo se desencadenan las reacciones químicas ha permitido avances significativos en numerosos campos, desde la ingeniería química hasta la física de partículas y la biología. Aunque el modelo ha evolucionado y se ha complementado con enfoques más sofisticados, sigue siendo un pilar esencial para el entendimiento de los procesos moleculares y una herramienta clave en el diseño de nuevas tecnologías y productos.
La comprensión de los mecanismos que rigen las colisiones moleculares no solo ha ampliado nuestro conocimiento fundamental de la naturaleza, sino que también ha permitido mejorar numerosos procesos industriales y científicos, beneficiando a sectores como la medicina, la energía, y la tecnología. Como tal, la teoría de colisiones continúa siendo una pieza fundamental en el rompecabezas de la ciencia moderna, y su estudio sigue siendo un área activa de investigación.


