El sodio (Na) es un metal alcalino, conocido por su alta reactividad, especialmente con el agua. Este elemento pertenece al grupo 1 de la tabla periódica y es extremadamente reactivo debido a su configuración electrónica, la cual tiene un solo electrón en su capa más externa. Esta característica lo hace propenso a ceder ese electrón para alcanzar una configuración más estable, similar a la de los gases nobles. Cuando el sodio entra en contacto con el agua, se produce una reacción química vigorosa y exotérmica, que es el foco de este análisis.
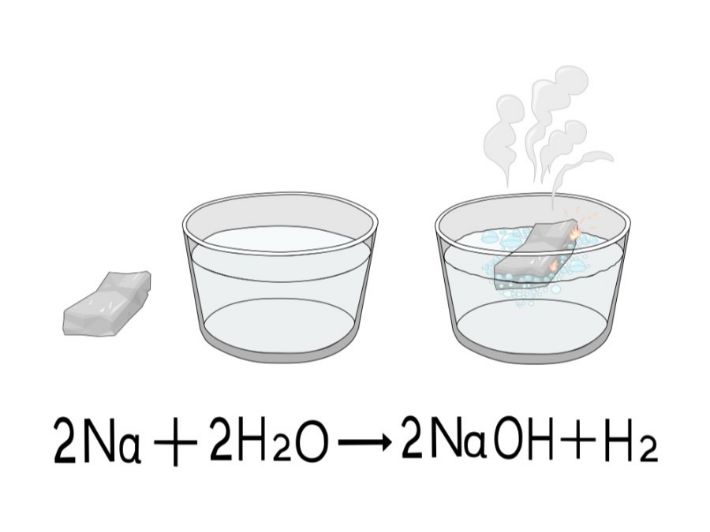
La reacción química: sodio y agua
La reacción entre el sodio y el agua se describe mediante la siguiente ecuación química:
2Na(s)+2H2O(l)→2NaOH(aq)+H2(g)
Esta ecuación indica que dos moles de sodio sólido reaccionan con dos moles de agua líquida para formar dos moles de hidróxido de sodio (NaOH) en solución acuosa y un mol de gas hidrógeno (H₂). Este proceso es altamente exotérmico, lo que significa que libera una cantidad significativa de calor, suficiente para que el hidrógeno producido pueda inflamarse espontáneamente en presencia del oxígeno del aire.
Desglose de la reacción:
-
Oxidación del sodio: En la primera etapa de la reacción, cada átomo de sodio pierde un electrón, lo que lo convierte en un ion de sodio con una carga positiva (Na+). Este proceso se conoce como oxidación, y se puede representar como:
Na→Na++e−
-
Reducción del agua: El agua, que actúa como agente oxidante, acepta el electrón liberado por el sodio, lo que conduce a la formación de iones hidróxido (OH−) y gas hidrógeno (H2). Esta parte de la reacción es la reducción y se describe mediante:
2H2O+2e−→2OH−+H2
-
Formación de hidróxido de sodio: Finalmente, los iones sodio (Na+) formados se combinan con los iones hidróxido (OH−) para dar lugar al hidróxido de sodio (NaOH):
Na++OH−→NaOH
Implicaciones de la reacción
Esta reacción tiene varias implicaciones tanto en el laboratorio como en aplicaciones industriales. El hidróxido de sodio, también conocido como soda cáustica, es una base fuerte que se usa ampliamente en la industria química, en la fabricación de papel, en la producción de jabón y en la purificación de petróleo. Además, el gas hidrógeno liberado es un combustible potencialmente útil, aunque en esta reacción se libera en cantidades relativamente pequeñas.
Aspectos de seguridad
La reacción del sodio con el agua no solo es exotérmica, sino que también es peligrosa si no se maneja adecuadamente. El calor generado puede ser suficiente para iniciar la combustión del hidrógeno liberado, lo que puede llevar a explosiones si el gas no se disipa correctamente. Por esta razón, el sodio debe manipularse con precaución en ambientes controlados, preferentemente en atmósferas inertes o sumergido en líquidos que no reaccionen, como el aceite mineral, para evitar un contacto accidental con el agua o la humedad del aire.
Reacciones relacionadas
Otros metales alcalinos, como el potasio (K) o el litio (Li), también reaccionan con el agua, pero la intensidad de la reacción varía. El potasio, por ejemplo, reacciona aún más violentamente que el sodio, mientras que el litio lo hace de manera más moderada. Esta reactividad creciente dentro del grupo 1 de la tabla periódica se debe a la energía de ionización, que disminuye al descender por el grupo, haciendo que los electrones de la capa externa se desprendan más fácilmente.
Aplicaciones y usos
El hidróxido de sodio producido en esta reacción es uno de los compuestos químicos más importantes en la industria. Su capacidad para neutralizar ácidos y formar sales lo convierte en un componente crucial en muchas reacciones químicas industriales. Además, la soda cáustica se utiliza en la fabricación de productos de limpieza, en la síntesis de compuestos orgánicos y en la producción de biodiésel. Por otro lado, el hidrógeno, aunque en esta reacción se genera en pequeñas cantidades, es un gas de interés en tecnologías emergentes, como las celdas de combustible y la producción de energía limpia.
Consideraciones termodinámicas
Desde un punto de vista termodinámico, la reacción del sodio con el agua es espontánea bajo condiciones estándar (25 °C y 1 atm de presión). La entalpía de reacción es negativa, lo que indica que el proceso libera energía al entorno. Esta liberación de energía se manifiesta no solo en la producción de calor, sino también en la formación de burbujas de hidrógeno que, al ser menos densas que el agua, ascienden rápidamente a la superficie.
Además, el aumento de la entropía del sistema, debido a la formación de gas hidrógeno a partir de líquidos y sólidos, también favorece la espontaneidad de la reacción. Esto significa que, termodinámicamente, la reacción está favorecida tanto por la liberación de calor (entalpía) como por el desorden generado (entropía).
Conclusión
El estudio de la reacción del sodio con el agua no solo es un tema fundamental en la química inorgánica, sino que también tiene amplias implicaciones prácticas e industriales. Entender las bases de esta reacción permite no solo predecir el comportamiento de otros metales alcalinos, sino también desarrollar aplicaciones útiles en la vida cotidiana y en la industria. Sin embargo, la manipulación de sodio y su interacción con el agua debe realizarse con extremo cuidado, dado el riesgo inherente de explosiones y quemaduras químicas.
Este ejemplo destaca cómo un concepto aparentemente simple, como la reacción de un metal con agua, puede tener profundos efectos en diversas áreas del conocimiento y la tecnología, desde la fabricación de productos esenciales hasta el desarrollo de nuevas fuentes de energía limpia.


