El Principio de Boyle y Su Importancia en la Física de Gases
El estudio del comportamiento de los gases ha sido fundamental en el desarrollo de la física y de varias aplicaciones prácticas en la ciencia y la ingeniería. Uno de los principios más importantes en esta área es el Principio de Boyle, también conocido como la Ley de Boyle, formulado por el científico irlandés Robert Boyle en el siglo XVII. Este principio establece una relación fundamental entre el volumen y la presión de un gas en un sistema cerrado, contribuyendo significativamente a la comprensión del comportamiento de los gases ideales. A lo largo de este artículo, exploraremos en detalle los conceptos detrás de esta ley, sus aplicaciones en el mundo real, y las ecuaciones matemáticas que la describen.
Conceptos Básicos: Gases Ideales y la Teoría Cinética
Para entender completamente la Ley de Boyle, es esencial primero revisar algunos conceptos básicos sobre los gases y la teoría cinética de los mismos. En física y química, los gases pueden modelarse como gases ideales, un modelo simplificado que asume que las partículas de gas son puntuales y no interactúan entre sí, salvo en colisiones elásticas. Bajo estas condiciones ideales, las partículas de gas se mueven constantemente y al azar, lo que genera presión cuando las partículas chocan con las paredes del contenedor que las contiene.
La teoría cinética de los gases relaciona esta presión con la energía cinética de las partículas individuales. Según esta teoría, la presión ejercida por un gas es proporcional al número de colisiones de las partículas con las paredes del contenedor y la energía de estas colisiones, ambas determinadas por la temperatura, el volumen y el número de partículas del gas.
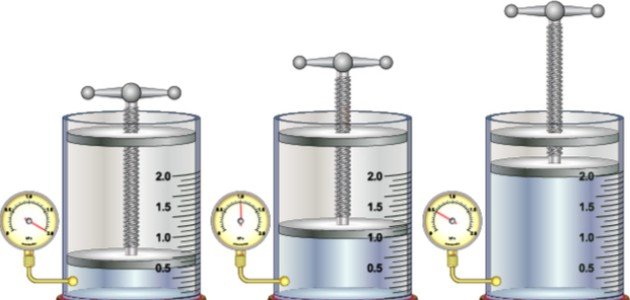
Ley de Boyle: Enunciado y Ecuación Matemática
La Ley de Boyle establece que, para una masa fija de gas ideal y a temperatura constante, el volumen del gas es inversamente proporcional a la presión. Matemáticamente, esta relación se expresa de la siguiente manera:
P×V=constante
donde:
- P es la presión del gas,
- V es el volumen del gas,
- y la constante representa el producto de P y V para un gas específico en condiciones de temperatura constante.
De esta ecuación, podemos observar que si la presión aumenta, el volumen disminuirá, y viceversa, siempre y cuando la temperatura se mantenga constante. Esta relación es la esencia de la Ley de Boyle.
Otra forma de escribir la ley es:
P1×V1=P2×V2
donde:
- P1 y V1 representan la presión y el volumen inicial del gas, y
- P2 y V2 representan la presión y el volumen después de un cambio en una de estas variables.
Esta segunda fórmula permite calcular el volumen o la presión resultante después de que se haya alterado una de estas propiedades.
Deducción de la Ley de Boyle desde la Teoría Cinética
La Ley de Boyle puede explicarse a partir de la teoría cinética de los gases. En un contenedor cerrado, las partículas de gas se mueven en todas direcciones y chocan con las paredes del contenedor, generando presión. Si reducimos el volumen del contenedor manteniendo constante la temperatura, las partículas de gas tienen menos espacio para moverse y, por lo tanto, chocan con las paredes con mayor frecuencia. Este incremento en la frecuencia de las colisiones produce un aumento en la presión. De esta manera, podemos ver que cuando el volumen disminuye, la presión aumenta, y viceversa, manteniendo constante el producto P×V.
Condiciones de Aplicación de la Ley de Boyle
La Ley de Boyle es una ley empírica, lo que significa que está basada en observaciones experimentales. Aunque es aplicable en una amplia variedad de situaciones, tiene ciertas limitaciones. Esta ley se cumple con precisión solo en condiciones ideales, lo que significa que se asume que el gas no presenta interacciones entre sus partículas y que las colisiones entre partículas y con las paredes del recipiente son elásticas (es decir, sin pérdida de energía). Sin embargo, en la práctica, la mayoría de los gases reales se comportan de manera similar a los gases ideales a temperaturas y presiones moderadas. En condiciones extremas de alta presión o baja temperatura, las desviaciones de la idealidad se vuelven significativas, y la Ley de Boyle pierde precisión.
Experimentos de Boyle y Su Método Científico
El propio Robert Boyle realizó varios experimentos para llegar a esta ley. Usando una jeringa y un tubo cerrado, Boyle pudo variar el volumen de un gas al cambiar la presión aplicada, observando y registrando cómo se modificaba la presión a medida que cambiaba el volumen. Estos experimentos fueron de los primeros ejemplos del uso del método científico en la física moderna, basándose en observaciones precisas, mediciones cuantitativas y conclusiones derivadas de datos experimentales.
Ejemplos y Aplicaciones de la Ley de Boyle
1. Respiración Humana
La respiración es un ejemplo cotidiano de la Ley de Boyle en acción. Al inhalar, el diafragma se contrae y desciende, aumentando el volumen de la cavidad torácica. Como resultado, la presión dentro de los pulmones disminuye, permitiendo que el aire entre para igualar la presión con el exterior. Al exhalar, el diafragma se relaja y el volumen de la cavidad torácica disminuye, lo que aumenta la presión interna y expulsa el aire.
2. Buceo y Descompresión
En el buceo, los buzos experimentan cambios en la presión a medida que descienden o ascienden en el agua. A mayor profundidad, la presión del agua aumenta y, según la Ley de Boyle, el volumen del gas en los pulmones y en el equipo de buceo se reduce. Este fenómeno es clave para entender el riesgo de sufrir enfermedad de descompresión si el buzo asciende demasiado rápido, ya que los gases disueltos en el cuerpo podrían expandirse rápidamente.
3. Uso en Seringas Médicas
Las jeringas funcionan con el principio de Boyle. Al tirar del émbolo de una jeringa, se aumenta el volumen dentro del cilindro, disminuyendo la presión y causando que el líquido fluya hacia la jeringa. Al empujar el émbolo hacia adelante, se reduce el volumen y aumenta la presión, expulsando el líquido.
Comparación con Otras Leyes de los Gases
La Ley de Boyle es solo una de las muchas leyes que describen el comportamiento de los gases. Estas leyes se pueden combinar para formar la ecuación general del gas ideal, que describe la relación entre presión, volumen, temperatura y número de moles de un gas. Esta ecuación es:
PV=nRT
donde:
- P es la presión,
- V es el volumen,
- n es el número de moles de gas,
- R es la constante de los gases ideales, y
- T es la temperatura en Kelvin.
En esta ecuación general, se puede derivar la Ley de Boyle al mantener constante la temperatura y el número de moles de gas, lo que nos devuelve a la relación inversa entre presión y volumen.
Tabla: Comparación de Leyes de los Gases
| Ley | Relación | Ecuación | Condiciones |
|---|---|---|---|
| Ley de Boyle | Presión – Volumen | P×V=constante | Temperatura constante |
| Ley de Charles | Volumen – Temperatura | V/T=constante | Presión constante |
| Ley de Avogadro | Volumen – Cantidad de gas | V/n=constante | Temperatura y presión constantes |
| Ley de Gay-Lussac | Presión – Temperatura | P/T=constante | Volumen constante |
Importancia en la Ciencia y Tecnología Modernas
La Ley de Boyle es fundamental en el diseño y funcionamiento de muchos sistemas y dispositivos que dependen de la manipulación de gases. Desde los motores de combustión interna hasta los sistemas de refrigeración y las bombas de vacío, el conocimiento de la relación entre presión y volumen es esencial para optimizar el rendimiento de estos sistemas.
Conclusión
La Ley de Boyle es un principio clave en la física de los gases, ofreciendo una relación inversa simple entre presión y volumen para un gas en condiciones ideales. A pesar de sus limitaciones en condiciones no ideales, esta ley es ampliamente aplicable en situaciones prácticas, incluyendo la respiración, el buceo y el uso de jeringas. Además, forma la base de la teoría de gases ideales, proporcionando una comprensión profunda del comportamiento de los gases y sirviendo como una herramienta invaluable en muchas aplicaciones científicas y tecnológicas.

