Ley de Beer-Lambert: Fundamentos y Aplicaciones en Espectrofotometría UV-Vis
Introducción
La Ley de Beer-Lambert es una de las leyes fundamentales en la espectrofotometría, especialmente en la espectrofotometría UV-Vis (Ultravioleta-Visible). Esta ley describe cómo la luz es absorbida por una sustancia cuando atraviesa una solución y cómo esta absorción está relacionada con la concentración de la sustancia y la longitud de la trayectoria óptica. En este artículo, exploraremos en detalle los principios detrás de la Ley de Beer-Lambert, su formulación matemática, las condiciones bajo las cuales es válida, así como sus aplicaciones en diversos campos científicos y técnicos.
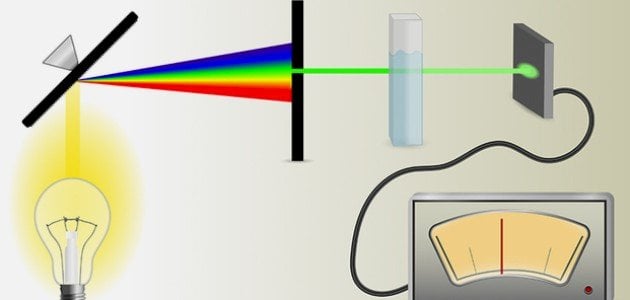
Fundamentos de la Ley de Beer-Lambert
Absorción de Luz y Espectrofotometría
La espectrofotometría es una técnica analítica utilizada para medir la cantidad de luz absorbida por una muestra a diferentes longitudes de onda. Esta absorción se debe a la interacción de la luz con las moléculas de la sustancia en la solución, donde ciertos componentes moleculares absorben luz a longitudes de onda específicas, lo que da lugar a un espectro de absorción característico.
La Ley de Beer-Lambert establece que la absorbancia (A) de una solución es directamente proporcional a la concentración (c) de la sustancia absorbente y a la longitud de la trayectoria óptica (l) de la célula de la muestra:
Donde:
- es la absorbancia, una medida adimensional de la cantidad de luz absorbida.
- es el coeficiente de absorción molar o absorbancia molar, que depende de la naturaleza de la sustancia y la longitud de onda de la luz utilizada.
- es la concentración de la solución en moles por litro (mol/L).
- es la longitud de la trayectoria óptica en centímetros (cm).
Orígenes Históricos
La Ley de Beer-Lambert es una combinación de dos leyes independientes propuestas por los científicos August Beer y Johann Heinrich Lambert. Lambert enunció en 1760 la relación entre la absorción de luz y la longitud de la trayectoria óptica, mientras que Beer, en 1852, añadió la dependencia con la concentración de la solución. La combinación de estas dos observaciones da lugar a la formulación que conocemos hoy.
Condiciones de Validez
Linealidad de la Ley
La Ley de Beer-Lambert es válida bajo condiciones específicas que garantizan una relación lineal entre la absorbancia y la concentración. Algunas de estas condiciones incluyen:
- Concentraciones Bajas a Moderadas: La ley es generalmente válida para soluciones diluidas. A concentraciones muy altas, las interacciones moleculares pueden causar desviaciones de la linealidad.
- Homogeneidad de la Solución: La solución debe ser homogénea y libre de partículas dispersantes que puedan afectar la trayectoria de la luz.
- Monocromatismo: La luz utilizada debe ser monocromática, es decir, de una sola longitud de onda, para asegurar que la absorción se debe a la misma transición electrónica en todas las moléculas.
Desviaciones de la Ley
En la práctica, existen varios factores que pueden causar desviaciones de la Ley de Beer-Lambert, tales como:
- Disolventes: Diferentes disolventes pueden cambiar el ambiente electrónico de las moléculas, afectando su coeficiente de absorción.
- Dispersión de Luz: En soluciones turbias o coloidales, la luz puede ser dispersada en lugar de absorbida, lo que altera la medida de absorbancia.
- Interacciones Moleculares: A altas concentraciones, las interacciones entre moléculas, como la formación de dímeros o la asociación molecular, pueden alterar la absorbancia.
Aplicaciones en Espectrofotometría UV-Vis
Determinación de Concentraciones
Una de las aplicaciones más comunes de la Ley de Beer-Lambert es la determinación de la concentración de una sustancia en solución. Esta técnica es ampliamente utilizada en laboratorios de química, biología y bioquímica. Para determinar la concentración, se mide la absorbancia de la muestra a una longitud de onda específica, y se utiliza la ley para calcular la concentración:
Esta metodología es fundamental en ensayos bioquímicos como la cuantificación de proteínas, ácidos nucleicos y otras biomoléculas.
Estudio de Equilibrios Químicos
La espectrofotometría UV-Vis también se emplea para estudiar equilibrios químicos en solución. Por ejemplo, la formación de complejos de coordinación entre un metal y un ligando puede ser monitoreada espectrofotométricamente al observar los cambios en el espectro de absorción. A partir de estos datos, es posible determinar constantes de equilibrio y estequiometría de las especies en solución.
Monitorización de Reacciones Químicas
Otra aplicación importante es la monitorización de reacciones químicas en tiempo real. Al medir la absorbancia en intervalos de tiempo regulares, se puede seguir el progreso de una reacción química y determinar su cinética. Esta técnica es especialmente útil en reacciones donde los productos o reactivos tienen espectros de absorción característicos.
Análisis de Mezclas
La Ley de Beer-Lambert también es útil para el análisis de mezclas. Si una mezcla contiene varios componentes que absorben a diferentes longitudes de onda, se pueden realizar medidas a múltiples longitudes de onda para determinar las concentraciones individuales de cada componente. Este enfoque es conocido como análisis espectrofotométrico multicomponente.
Instrumentación en Espectrofotometría UV-Vis
Fuente de Luz
La fuente de luz en un espectrofotómetro UV-Vis debe ser capaz de emitir luz en el rango ultravioleta (200-400 nm) y visible (400-700 nm). Comúnmente se utilizan lámparas de deuterio para el rango UV y lámparas de tungsteno o halógenas para el rango visible. Estas fuentes de luz deben ser estables y tener una alta intensidad para asegurar medidas precisas.
Monocromador
El monocromador es un componente crucial que selecciona la longitud de onda de la luz que atraviesa la muestra. Los monocromadores pueden ser prismas o rejillas de difracción que dispersan la luz en sus componentes espectrales. La precisión y resolución del monocromador determinan la calidad del espectro obtenido.
Celdas de Muestra
Las celdas de muestra, o cubetas, deben ser de un material transparente en el rango de longitudes de onda de interés. Para medidas en el rango visible, se utilizan cubetas de vidrio o plástico, mientras que para el rango UV se prefieren cubetas de cuarzo debido a su alta transparencia en esta región.
Detector
El detector convierte la luz transmitida a través de la muestra en una señal eléctrica que puede ser medida. Los fotodiodos y los tubos fotomultiplicadores son detectores comunes en espectrofotómetros UV-Vis. Los detectores deben ser sensibles y tener una respuesta lineal a la intensidad de la luz.
Ejemplos Prácticos de la Ley de Beer-Lambert
Cuantificación de ADN
En biología molecular, la cuantificación de ADN mediante espectrofotometría UV-Vis es una técnica estándar. El ADN tiene un pico de absorción característico a 260 nm debido a la presencia de bases nitrogenadas. Midiendo la absorbancia a esta longitud de onda y aplicando la Ley de Beer-Lambert, se puede determinar la concentración de ADN en una muestra.
Determinación de Colorantes en Alimentos
En la industria alimentaria, la Ley de Beer-Lambert se utiliza para medir la concentración de colorantes en productos alimenticios. Esto es crucial para garantizar que los productos cumplan con las normativas de seguridad alimentaria y tengan la apariencia deseada.
Monitoreo de la Contaminación Ambiental
La espectrofotometría UV-Vis es una herramienta valiosa en la monitorización de contaminantes en agua y aire. Por ejemplo, la concentración de nitratos en el agua se puede determinar midiendo la absorbancia a 220 nm. De manera similar, los hidrocarburos aromáticos policíclicos (PAH) en el aire pueden ser detectados mediante sus características de absorción UV.
Ventajas y Limitaciones de la Ley de Beer-Lambert
Ventajas
- Simplicidad: La Ley de Beer-Lambert ofrece una relación directa y sencilla entre la absorbancia y la concentración, lo que facilita su aplicación en análisis cuantitativos.
- Sensibilidad: Es una técnica sensible que permite detectar concentraciones muy bajas de sustancias en solución.
- Versatilidad: La ley es aplicable a una amplia gama de compuestos y es fundamental en muchas disciplinas científicas.
Limitaciones
- Desviaciones de Linealidad: Como se mencionó anteriormente, a concentraciones muy altas o en condiciones no ideales, la ley puede no ser lineal.
- Dependencia del Solvente: Cambios en el solvente pueden afectar el coeficiente de absorción molar, complicando la interpretación de los resultados.
- Necesidad de Monocromatismo: La necesidad de luz monocromática limita el rango de aplicaciones, especialmente en espectros de absorción complejos.
Conclusión
La Ley de Beer-Lambert es una herramienta fundamental en la espectrofotometría UV-Vis, proporcionando una base sólida para la cuantificación y el análisis de sustancias en solución. A pesar de sus limitaciones, su aplicación en diversos campos como la química, biología, medicina y control de calidad industrial es invaluable. Comprender los principios subyacentes y las condiciones bajo las cuales esta ley es aplicable permite a los científicos y técnicos obtener datos precisos y reproducibles, contribuyendo al avance del conocimiento científico y a la solución de problemas prácticos en la industria.
Referencias
- Hollas, J. M. (2004). Modern Spectroscopy. John Wiley & Sons.
- Skoog, D. A., Holler, F. J., & Crouch, S. R. (2017). Principles of Instrumental Analysis. Cengage Learning.
- Banwell, C. N., & McCash, E. M. (1994). Fundamentals of Molecular Spectroscopy. McGraw-Hill.
Este artículo ofrece una visión detallada de la Ley de Beer-Lambert y su importancia en la espectrofotometría UV-Vis, proporcionando un recurso valioso para estudiantes, investigadores y profesionales en el campo de las ciencias analíticas.
Más Informaciones


