Nociones Fundamentales sobre los Isótopos: Conceptos y Aplicaciones
Los isótopos son variantes de un mismo elemento químico que poseen el mismo número atómico, pero difieren en su número de masa debido a la presencia de un número diferente de neutrones en el núcleo. Esta diferencia en la composición nuclear otorga a los isótopos propiedades únicas que son fundamentales en diversos campos, desde la química y la física hasta la medicina y la arqueología. En este artículo, se explorarán las características de los isótopos, sus tipos, sus aplicaciones prácticas y su importancia en la investigación científica.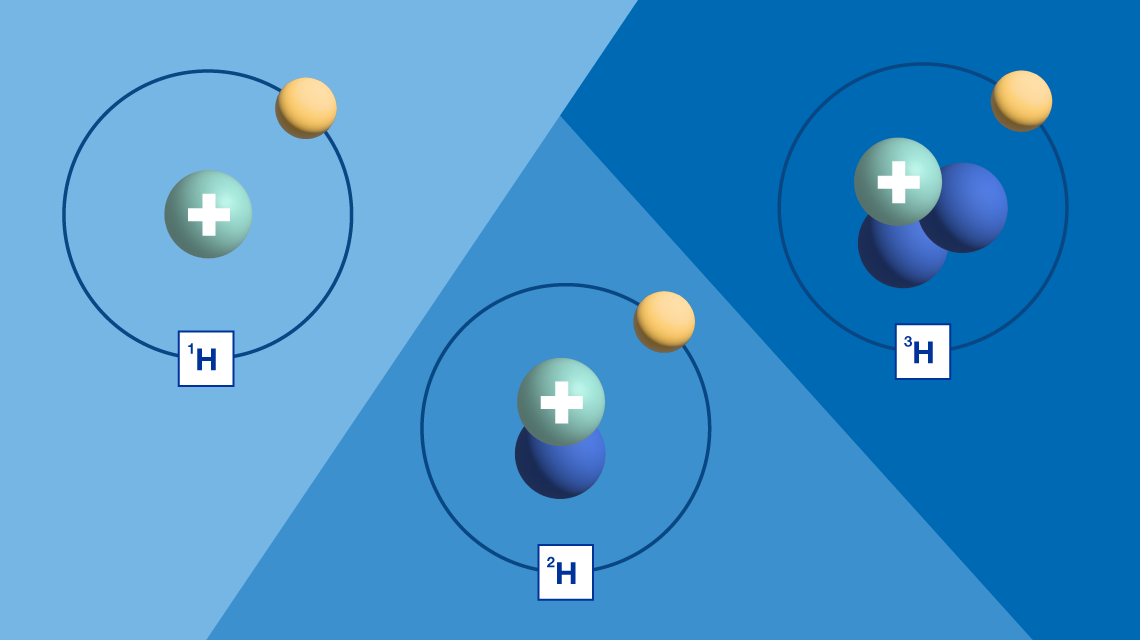
1. Definición y Clasificación de Isótopos
Los isótopos se clasifican en dos categorías principales: isótopos estables e inestables.
- Isótopos Estables: Estos isótopos no sufren desintegración radiactiva. Un ejemplo común es el carbono-12 (¹²C), que constituye la mayor parte del carbono en la naturaleza. Los isótopos estables son esenciales en diversas aplicaciones, como en la datación y la investigación química, ya que no generan radiación que podría interferir con los experimentos.
- Isótopos Inestables (Radiactivos): Estos isótopos se descomponen con el tiempo, liberando energía en forma de radiación. Un ejemplo notable es el carbono-14 (¹⁴C), utilizado en la datación por radiocarbono. Los isótopos radiactivos tienen aplicaciones significativas en medicina, como en la terapia de radiación y en la obtención de imágenes médicas.
2. Propiedades de los Isótopos
Las propiedades químicas de los isótopos son generalmente idénticas, dado que la química de un elemento está determinada por el número de protones (número atómico) y la configuración electrónica. Sin embargo, las propiedades físicas, como la masa y la estabilidad, pueden diferir. Esta variación permite a los científicos utilizar isótopos como trazadores en diversas investigaciones.
2.1. Masa Atómica
La masa atómica de un isótopo se determina por la suma de protones y neutrones en el núcleo. Esto afecta su comportamiento en reacciones químicas y su interacción con la radiación.
2.2. Estabilidad Nuclear
Los isótopos estables tienen un equilibrio entre protones y neutrones, mientras que los isótopos inestables tienden a tener un exceso de neutrones, lo que los hace propensos a la desintegración radiactiva. Este proceso de descomposición es una fuente de energía que puede ser aprovechada en diversas aplicaciones, incluyendo la generación de electricidad y la terapia contra el cáncer.
3. Aplicaciones de los Isótopos
Los isótopos tienen una amplia gama de aplicaciones en diferentes disciplinas. A continuación, se destacan algunas de las más relevantes:
3.1. Datación por Radiocarbono
La técnica de datación por radiocarbono se basa en el uso del isótopo radiactivo carbono-14. Este método permite determinar la edad de objetos orgánicos hasta aproximadamente 50,000 años. A medida que los organismos mueren, el carbono-14 se descompone a un ritmo constante, permitiendo a los científicos estimar el tiempo transcurrido desde la muerte del organismo.
3.2. Medicina Nuclear
En medicina, los isótopos radiactivos se utilizan en diagnósticos y tratamientos. Por ejemplo, el yodo-131 se emplea en el tratamiento de enfermedades tiroideas, mientras que el tecnecio-99m se utiliza en estudios de imagen para evaluar el funcionamiento de órganos. Estos isótopos proporcionan información valiosa sobre la salud de los pacientes.
3.3. Investigación Científica
Los isótopos estables y radiactivos son herramientas esenciales en la investigación científica. Se utilizan como trazadores en estudios de biología, química y ecología, permitiendo a los investigadores seguir el movimiento de sustancias dentro de sistemas biológicos y ambientales.
4. Conclusiones
Los isótopos son componentes cruciales en la ciencia moderna, proporcionando una comprensión más profunda de los procesos naturales y mejorando la calidad de vida a través de aplicaciones en medicina y tecnología. A medida que la investigación avanza, es probable que se descubran nuevas aplicaciones y se profundice aún más en la comprensión de sus propiedades y comportamientos. La capacidad de los isótopos para ofrecer perspectivas únicas en una variedad de disciplinas subraya su importancia en el mundo contemporáneo.
Referencias
- Faure, G. (1986). Principles of Isotope Geology. John Wiley & Sons.
- Burch, W. R. (2011). Radiocarbon Dating: A New Perspective. Cambridge University Press.
- Knoll, A. H., & Barghoorn, E. S. (1971). «Biological Implications of the Use of Isotopes.» Science.
Este artículo proporciona una visión general integral sobre los isótopos, abordando su definición, clasificación, propiedades y aplicaciones en la vida cotidiana y la investigación científica. A medida que la ciencia continúa avanzando, la comprensión y el uso de isótopos seguirán evolucionando, aportando a nuevas fronteras de conocimiento y tecnología.

