El Número Atómico y el Peso Atómico: Fundamentos de la Química Moderna
En el vasto campo de la química, dos conceptos fundamentales sirven como pilares sobre los cuales se construye nuestro entendimiento de la materia: el número atómico y el peso atómico. Estos conceptos, desarrollados y refinados a lo largo de décadas de investigación y experimentación, son esenciales para comprender la estructura y el comportamiento de los átomos, los bloques fundamentales de la materia.
El Número Atómico: Identidad de un Átomo
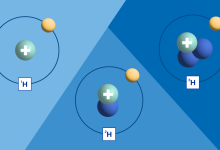
El número atómico de un átomo es una propiedad característica que define su identidad única en el universo químico. Representado por la letra Z, este número indica la cantidad de protones presentes en el núcleo del átomo. Los protones, partículas subatómicas con carga positiva, determinan las propiedades químicas del elemento.
Para cada elemento químico conocido, el número atómico es único y no varía. Por ejemplo, el hidrógeno, el elemento más simple, tiene un número atómico de 1, lo que significa que su núcleo contiene un solo protón. El uranio, uno de los elementos más pesados naturalmente presentes en la Tierra, tiene un número atómico de 92, indicando la presencia de 92 protones en su núcleo.
El descubrimiento del número atómico fue un avance crucial en la comprensión de la estructura atómica. Fue propuesto inicialmente por Henry Moseley en 1913, quien demostró que el número atómico es la propiedad que define la secuencia de los elementos en la tabla periódica de los elementos. Esta secuencia, organizada por el número creciente de protones en el núcleo atómico, proporciona una representación ordenada y sistemática de todos los elementos conocidos.
El Peso Atómico: Promedio Ponderado de Isótopos
El peso atómico de un elemento, a menudo denotado como A, es un valor promedio ponderado de las masas de los átomos isotópicos de ese elemento en la naturaleza. Los átomos de un elemento pueden tener diferentes números de neutrones en sus núcleos, creando así diversas versiones llamadas isótopos. Aunque el número de protones (y por lo tanto el número atómico) permanece constante para un elemento dado, el número de neutrones puede variar.
El peso atómico se calcula considerando la abundancia relativa de cada isótopo y su masa atómica. Por ejemplo, el carbono, un elemento con un número atómico de 6, tiene tres isótopos principales: carbono-12, carbono-13 y carbono-14. La mayoría del carbono en la naturaleza es carbono-12, seguido por una pequeña cantidad de carbono-13 y una traza de carbono-14, cada uno con su propia masa atómica.
Para determinar el peso atómico del carbono, se multiplica la masa de cada isótopo por su abundancia relativa (expresada como fracción decimal) y se suman estos productos. El resultado es el valor promedio ponderado de la masa de los átomos de carbono en una muestra típica. En este caso, el peso atómico del carbono es aproximadamente 12.01 u (unidades de masa atómica), reflejando la contribución relativa de cada isótopo a la masa total.
Relación entre Número Atómico y Propiedades Químicas
El número atómico de un elemento determina su disposición en la tabla periódica y está estrechamente relacionado con sus propiedades químicas. Los elementos con números atómicos similares tienden a exhibir comportamientos químicos y propiedades físicas similares debido a la configuración electrónica de sus átomos. Esta configuración, influenciada por el número de protones en el núcleo, dicta cómo los átomos interactúan entre sí para formar compuestos y moléculas.
Por ejemplo, los elementos alcalinos como el sodio y el potasio, que tienen números atómicos bajos y por lo tanto pocos electrones en sus capas externas, son altamente reactivos y tienden a formar compuestos iónicos con otros elementos. En contraste, los gases nobles como el helio y el neón, con números atómicos más altos y una configuración electrónica estable en su capa externa, son químicamente inertes y rara vez reaccionan con otros elementos.
Aplicaciones en la Ciencia y la Tecnología
El conocimiento del número atómico y del peso atómico es fundamental en una amplia gama de disciplinas científicas y tecnológicas. En la química analítica, por ejemplo, se utilizan técnicas como la espectroscopia de masas para determinar la composición isotópica de muestras desconocidas, lo que proporciona información crucial sobre su origen y composición.
En la industria nuclear, la comprensión de los números atómicos y los pesos atómicos es esencial para el diseño y la operación segura de reactores nucleares, así como para la gestión segura de desechos radiactivos. Además, en la medicina, la radioterapia y la medicina nuclear dependen de la radiactividad y las propiedades de los isótopos para diagnóstico y tratamiento.
Conclusión
El número atómico y el peso atómico son conceptos esenciales que han revolucionado nuestra comprensión del mundo a nivel atómico y molecular. Desde su descubrimiento inicial hasta su aplicación en diversas áreas científicas y tecnológicas, estos conceptos han demostrado ser fundamentales para explicar las propiedades y el comportamiento de la materia en sus formas más básicas.
A medida que la investigación continúa y la tecnología avanza, seguirán desempeñando un papel crucial en la exploración de nuevos materiales, el desarrollo de tecnologías más eficientes y la comprensión más profunda de los fenómenos naturales. El número atómico y el peso atómico son, en última instancia, herramientas indispensables en el arsenal del científico moderno, facilitando el progreso y la innovación en el campo de la química y más allá.
Más Informaciones

El Número Atómico y el Peso Atómico: Fundamentos de la Química Moderna
En el vasto panorama de la química moderna, dos conceptos fundamentales emergen como pilares inquebrantables sobre los cuales se construye nuestro entendimiento de la materia: el número atómico y el peso atómico. Estos conceptos no solo delinean la identidad única de cada elemento en el universo, sino que también son cruciales para entender sus propiedades físicas y químicas, así como su comportamiento en una amplia variedad de contextos.
El Número Atómico: Definición y Significado
El número atómico (Z) de un átomo es una propiedad intrínseca que determina su identidad como un elemento específico. Se define como la cantidad de protones presentes en el núcleo de un átomo. Los protones son partículas subatómicas con carga positiva que junto con los neutrones, forman el núcleo atómico, mientras que los electrones, con carga negativa, orbitan alrededor del núcleo.
Desde la perspectiva histórica, el concepto de número atómico marcó un hito significativo en el desarrollo de la química moderna. Fue propuesto inicialmente por el científico británico Henry Moseley en 1913, quien demostró que el número atómico es la propiedad fundamental que determina la posición de un elemento en la tabla periódica de los elementos. Esta tabla, una disposición sistemática de los elementos basada en sus propiedades químicas y físicas, ordena los elementos de manera creciente según su número atómico.
Cada elemento en la tabla periódica tiene un número atómico único y específico. Por ejemplo, el hidrógeno, el elemento más simple y abundante en el universo, tiene un número atómico de 1, lo que significa que su núcleo contiene un solo protón. En contraste, el uranio, uno de los elementos más pesados naturalmente presentes en la Tierra, tiene un número atómico de 92, indicando que su núcleo está compuesto por 92 protones.
El Peso Atómico: Composición y Cálculo
El peso atómico de un elemento (A) es un valor promedio ponderado de las masas de los átomos isotópicos de ese elemento en la naturaleza. Los átomos de un elemento pueden existir en diferentes formas conocidas como isótopos, los cuales tienen el mismo número de protones pero difieren en el número de neutrones en el núcleo. Debido a estas variaciones en la composición isotópica, el peso atómico no es un número entero, sino una media ponderada de las masas de los isótopos.
Para calcular el peso atómico de un elemento, se toma en cuenta la abundancia relativa de cada isótopo y su masa atómica. Por ejemplo, el carbono, un elemento fundamental para la vida y numerosas aplicaciones tecnológicas, tiene tres isótopos principales: carbono-12, carbono-13 y carbono-14. La mayoría del carbono en la naturaleza es carbono-12, seguido por una pequeña cantidad de carbono-13 y una traza de carbono-14. El peso atómico del carbono se calcula sumando la masa de cada isótopo multiplicada por su abundancia relativa.
El conocimiento del peso atómico es esencial para una variedad de aplicaciones científicas y tecnológicas. En la química analítica, por ejemplo, se utiliza para determinar la composición exacta de materiales desconocidos mediante técnicas como la espectroscopia de masas. También es fundamental en la industria nuclear para el diseño y la operación de reactores nucleares, así como en la medicina nuclear para diagnósticos y tratamientos precisos.
Relación entre Número Atómico y Propiedades Químicas
El número atómico de un elemento juega un papel crucial en la determinación de sus propiedades químicas. La configuración electrónica de un átomo, determinada por el número de electrones que rodean el núcleo, está directamente influenciada por el número de protones en el núcleo (es decir, el número atómico). Esta configuración electrónica dicta cómo un átomo interactúa con otros átomos para formar enlaces químicos y compuestos.
Los elementos con números atómicos similares tienden a exhibir comportamientos químicos y propiedades físicas similares. Por ejemplo, los metales alcalinos como el sodio (Na) y el potasio (K), que tienen números atómicos bajos y por lo tanto pocos electrones en sus capas exteriores, son altamente reactivos y tienden a formar compuestos iónicos con otros elementos. En contraste, los gases nobles como el helio (He) y el neón (Ne), con números atómicos más altos y configuraciones electrónicas estables, son químicamente inertes y rara vez forman compuestos con otros elementos.
Aplicaciones en la Ciencia y la Tecnología
El número atómico y el peso atómico son herramientas indispensables en una amplia gama de disciplinas científicas y tecnológicas. En la arqueología y la geología, por ejemplo, se utilizan para datar y estudiar materiales antiguos utilizando métodos isotópicos como la datación por radiocarbono y la datación por uranio-plomo. En la medicina, son cruciales para el desarrollo de radiofármacos y técnicas de imagenología molecular que permiten diagnosticar enfermedades y tratarlas de manera precisa.
En la investigación de materiales y la nanotecnología, el conocimiento del número atómico y el peso atómico es esencial para diseñar materiales con propiedades específicas, como conductividad eléctrica, resistencia mecánica y reactividad química controlada. Además, en la industria alimentaria y agrícola, son utilizados para estudiar la composición y la estructura molecular de nutrientes y pesticidas, mejorando así la producción y la seguridad alimentaria.
Futuro de la Investigación y Aplicaciones
A medida que avanzan la ciencia y la tecnología, el estudio del número atómico y el peso atómico continúa evolucionando. Los avances en técnicas analíticas y computacionales permiten una comprensión más profunda de la estructura atómica y molecular, abriendo nuevas posibilidades en áreas como la nanotecnología, la medicina personalizada y la exploración espacial.
En conclusión, el número atómico y el peso atómico son conceptos fundamentales que subyacen a nuestra comprensión de la materia a nivel atómico y molecular. Desde su formulación inicial hasta sus aplicaciones prácticas en diversas disciplinas científicas y tecnológicas, estos conceptos han sido y seguirán siendo piedras angulares del progreso científico y la innovación tecnológica en el siglo XXI y más allá.