Elementos y Compuestos Químicos: Una Exploración Profunda
La química, como ciencia fundamental, se ocupa de la composición, estructura y propiedades de la materia. En el núcleo de esta disciplina se encuentran los elementos y compuestos químicos, conceptos que son esenciales para comprender no solo la química misma, sino también los procesos biológicos, físicos y tecnológicos que dan forma a nuestro mundo. Este artículo se propone explorar en profundidad la naturaleza, características y aplicaciones de los elementos y compuestos químicos, así como su importancia en diversas áreas del conocimiento y la vida cotidiana.
1. Definición de Elementos y Compuestos Químicos
Los elementos químicos son sustancias puras que no pueden descomponerse en sustancias más simples por métodos químicos. Cada elemento está constituido por átomos que comparten el mismo número de protones en sus núcleos, lo que se conoce como número atómico. Actualmente, se conocen 118 elementos, de los cuales 94 ocurren de forma natural en la Tierra, mientras que los restantes son sintéticos y han sido creados en laboratorios.
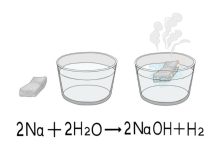
Los compuestos químicos, en contraste, son sustancias formadas por la combinación de dos o más elementos en proporciones fijas. Estos elementos se unen mediante enlaces químicos, y sus propiedades difieren drásticamente de las de los elementos que los componen. Un ejemplo clásico es el agua (H₂O), que es un compuesto formado por dos átomos de hidrógeno y uno de oxígeno. Las propiedades del agua, como su capacidad de disolución y su comportamiento en estado líquido, son muy diferentes de las de los gases que la componen.
2. La Tabla Periódica de los Elementos
La Tabla Periódica, creada por Dmitri Mendeléyev en 1869, organiza los elementos químicos en función de su número atómico y sus propiedades químicas. Esta herramienta no solo permite a los científicos identificar elementos y predecir sus comportamientos, sino que también ofrece información crucial sobre sus similitudes y diferencias.
2.1 Grupos y Períodos
Los elementos en la tabla se agrupan en columnas llamadas grupos, que comparten características similares, como la reactividad y el tipo de enlaces que forman. Por ejemplo, los metales alcalinos (grupo 1) son altamente reactivos y tienden a formar compuestos iónicos. Por otro lado, los elementos en la misma fila, conocidos como períodos, presentan tendencias en sus propiedades a medida que se avanza a lo largo de la tabla.
2.2 Metales, No Metales y Metaloides
Los elementos pueden clasificarse en tres categorías principales: metales, no metales y metaloides.
-
Metales: Generalmente, los metales son buenos conductores de electricidad y calor, y tienen un alto punto de fusión y ebullición. Ejemplos incluyen el hierro (Fe) y el cobre (Cu).
-
No Metales: Estos elementos suelen ser malos conductores y tienen puntos de fusión y ebullición más bajos. Ejemplos incluyen el oxígeno (O) y el carbono (C).
-
Metaloides: Poseen propiedades intermedias entre metales y no metales. El silicio (Si) es un ejemplo notable, especialmente en su aplicación en la tecnología de semiconductores.
3. Propiedades de los Elementos
Las propiedades de los elementos pueden clasificarse en varias categorías, como propiedades físicas, químicas y mecánicas.
3.1 Propiedades Físicas
Las propiedades físicas incluyen características observables y medibles, como:
-
Estado de la Materia: Los elementos pueden existir en estado sólido, líquido o gaseoso a temperatura ambiente. Por ejemplo, el mercurio (Hg) es un líquido, mientras que el helio (He) es un gas.
-
Punto de Fusión y Ebullición: Cada elemento tiene un punto específico en el que cambia de estado. Estos puntos son cruciales en aplicaciones industriales y científicas.
-
Densidad: La densidad, que se define como la masa por unidad de volumen, es una propiedad clave que determina cómo un elemento interactúa con otros materiales.
3.2 Propiedades Químicas
Las propiedades químicas describen cómo un elemento reacciona con otros elementos y compuestos. Estas reacciones son fundamentales en procesos como la combustión, la corrosión y la formación de compuestos orgánicos.
-
Reactividad: La tendencia de un elemento a participar en reacciones químicas varía considerablemente. Por ejemplo, los metales alcalinos son altamente reactivos, mientras que los gases nobles son casi inertes.
-
Electronegatividad: Este término describe la capacidad de un átomo para atraer electrones en un enlace químico. Los elementos con alta electronegatividad, como el flúor (F), tienden a formar enlaces covalentes fuertes.
4. Compuestos Químicos: Formación y Clasificación
Los compuestos químicos se forman a través de reacciones químicas que implican la combinación de átomos de diferentes elementos. Estas reacciones pueden ser simples, como la combinación de hidrógeno y oxígeno para formar agua, o complejas, como las que ocurren en la síntesis de compuestos orgánicos.
4.1 Tipos de Compuestos
Los compuestos químicos se pueden clasificar en varias categorías según su tipo de enlace:
-
Compuestos Iónicos: Formados por la transferencia de electrones de un elemento a otro, resultando en la formación de iones cargados que se atraen entre sí. Un ejemplo es el cloruro de sodio (NaCl).
-
Compuestos Covalentes: Formados por el compartir electrones entre átomos. El dióxido de carbono (CO₂) es un ejemplo típico, donde el carbono comparte electrones con dos átomos de oxígeno.
-
Compuestos Metálicos: Compuestos que incluyen metales, en los cuales los electrones son compartidos en una red que permite la conductividad eléctrica y térmica. El bronce es un ejemplo de un compuesto metálico.
5. Aplicaciones de Elementos y Compuestos Químicos
Los elementos y compuestos químicos son fundamentales en una variedad de aplicaciones, desde la medicina hasta la ingeniería y la industria alimentaria.
5.1 En Medicina
Los elementos y compuestos son esenciales en la fabricación de medicamentos. Por ejemplo, el oxígeno es crucial para la respiración celular, mientras que compuestos como la penicilina han revolucionado el tratamiento de infecciones bacterianas.
5.2 En Tecnología
Los metales y compuestos semiconductores son la base de la tecnología moderna. Elementos como el silicio son fundamentales en la fabricación de dispositivos electrónicos, mientras que otros metales, como el oro y la plata, son utilizados en la fabricación de componentes eléctricos.
5.3 En la Industria Alimentaria
Los compuestos químicos también juegan un papel importante en la industria alimentaria. Desde conservantes hasta aditivos, los compuestos afectan la seguridad y calidad de los alimentos. Por ejemplo, el ácido ascórbico (vitamina C) es un antioxidante que se utiliza para preservar la frescura de los productos alimenticios.
6. Impacto Ambiental y Sostenibilidad
El estudio de los elementos y compuestos también es crucial en el contexto de la sostenibilidad y el impacto ambiental. La minería de metales, el uso de pesticidas y la producción de plásticos han llevado a preocupaciones sobre la contaminación y el agotamiento de recursos.
6.1 Contaminación Química
Muchos compuestos, como los hidrocarburos y metales pesados, son contaminantes que afectan la salud humana y el medio ambiente. Comprender la química de estos compuestos es vital para desarrollar estrategias de mitigación y remediación.
6.2 Sostenibilidad
La química también ofrece soluciones para la sostenibilidad. El desarrollo de materiales biodegradables y la investigación en energía limpia, como las pilas de combustible y la energía solar, son ejemplos de cómo la química puede contribuir a un futuro más sostenible.
7. Conclusión
Los elementos y compuestos químicos son fundamentales para la comprensión de la materia y su interacción en el mundo. Desde su clasificación en la tabla periódica hasta sus aplicaciones en la vida cotidiana, su estudio revela la complejidad y belleza de la química. A medida que avanzamos en la era de la tecnología y la sostenibilidad, es esencial seguir explorando y entendiendo los principios químicos que subyacen en los procesos naturales y artificiales. En última instancia, esta comprensión no solo enriquecerá nuestro conocimiento científico, sino que también nos permitirá abordar los desafíos globales con un enfoque más informado y responsable.
Referencias
- Atkins, P. W., & Friedman, R. (2011). Molecular Quantum Mechanics. Oxford University Press.
- Chang, R. (2010). Chemistry. McGraw-Hill.
- Berg, J. M., Tymoczko, J. L., & Stryer, L. (2012). Biochemistry. W.H. Freeman and Company.
- Lavoisier, A. (1789). Traité Élémentaire de Chimie. Chez Cuchet.
Este artículo busca proporcionar una visión exhaustiva de los elementos y compuestos químicos, subrayando su relevancia en múltiples disciplinas y su impacto en nuestra vida diaria. La exploración continua de estos conceptos es fundamental para el avance de la ciencia y la tecnología en el futuro.