Características de los Compuestos Iónicos
Los compuestos iónicos representan una de las categorías fundamentales en la química y se forman a través de la interacción entre iones positivos y negativos. Estos compuestos juegan un papel crucial en numerosos procesos biológicos, químicos y físicos, y entender sus propiedades es esencial para el estudio de la química. A continuación, se exploran en detalle las características principales de los compuestos iónicos, abordando su estructura, propiedades físicas, y su comportamiento en distintas condiciones.
1. Estructura Cristalina
Los compuestos iónicos se organizan en una estructura cristalina altamente ordenada, conocida como red iónica. En esta estructura, los iones positivos (cationes) y negativos (aniones) están dispuestos en un patrón regular y repetitivo, lo que resulta en un sólido con una forma geométrica definida. La disposición de los iones en esta red maximiza la atracción electrostática entre cargas opuestas y minimiza la repulsión entre cargas similares, contribuyendo a la estabilidad del compuesto.
2. Enlaces Iónicos
El enlace iónico es una fuerza de atracción electrostática que mantiene unidos a los iones en un compuesto iónico. Este tipo de enlace se forma cuando un átomo cede uno o más electrones para convertirse en un catión, mientras que otro átomo acepta esos electrones para convertirse en un anión. La transferencia de electrones resulta en la formación de iones con cargas opuestas que se atraen entre sí, formando el enlace iónico. La diferencia significativa en la electronegatividad entre los átomos involucrados favorece la formación de este tipo de enlace.
3. Propiedades Físicas
a. Punto de Fusión y ebullición
Los compuestos iónicos suelen tener puntos de fusión y ebullición elevados en comparación con los compuestos covalentes. Esto se debe a la fuerte atracción electrostática entre los iones de carga opuesta en la red cristalina, que requiere una cantidad significativa de energía para superar. Por ejemplo, el cloruro de sodio (NaCl) tiene un punto de fusión de aproximadamente 801°C, mientras que el cloruro de potasio (KCl) tiene un punto de fusión de 770°C.
b. Solubilidad en Agua
Muchos compuestos iónicos son solubles en agua. La solubilidad se debe a la capacidad del agua para rodear y estabilizar los iones. Cuando un compuesto iónico se disuelve en agua, las moléculas de agua rodean los iones y los separan, permitiendo que se mezclen con el agua. Esta interacción se debe a la polaridad del agua, que puede interactuar eficazmente con los iones. Sin embargo, la solubilidad de los compuestos iónicos puede variar dependiendo de la naturaleza de los iones y la temperatura del agua.
c. Conductividad Eléctrica
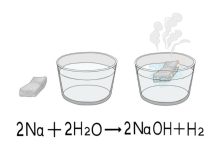
En estado sólido, los compuestos iónicos no conducen la electricidad, ya que los iones están fijos en la red cristalina y no pueden moverse libremente. Sin embargo, cuando se disuelven en agua o se funden, los iones se vuelven móviles y, por lo tanto, el compuesto iónico en solución o en estado fundido puede conducir la electricidad. Esta propiedad es utilizada en diversas aplicaciones, como en las baterías y en la electrolisis.
d. Dureza y Fragilidad
Los compuestos iónicos son generalmente duros debido a la fuerte atracción electrostática entre los iones. Sin embargo, son también frágiles. Esta fragilidad se debe a la estructura cristalina, donde una aplicación de fuerza puede desplazar los iones de tal manera que se alineen cargas similares, causando repulsión y rompiendo el cristal. Esta característica hace que los compuestos iónicos se rompan fácilmente bajo presión, en lugar de deformarse.
4. Ejemplos Comunes de Compuestos Iónicos
Entre los compuestos iónicos más conocidos se encuentran el cloruro de sodio (NaCl), también conocido como sal de mesa, y el cloruro de potasio (KCl). Otros ejemplos incluyen el fluoruro de sodio (NaF), el sulfato de calcio (CaSO₄), y el óxido de magnesio (MgO). Cada uno de estos compuestos exhibe las características típicas de los compuestos iónicos, como altos puntos de fusión, solubilidad en agua, y capacidad para conducir la electricidad en estado fundido o en solución.
5. Aplicaciones de los Compuestos Iónicos
Los compuestos iónicos tienen una amplia gama de aplicaciones prácticas. En la industria alimentaria, la sal de mesa (NaCl) se utiliza tanto para dar sabor como para conservar alimentos. En la medicina, algunos compuestos iónicos se utilizan en la formulación de medicamentos y soluciones intravenosas. Además, los compuestos iónicos son fundamentales en la fabricación de materiales cerámicos y en la industria del vidrio. La capacidad de los compuestos iónicos para conducir electricidad en estado fundido también es crucial en procesos electroquímicos como la obtención de metales a partir de sus minerales.
6. Consideraciones Ambientales y de Seguridad
Aunque los compuestos iónicos son esenciales en muchas aplicaciones, también es importante considerar su impacto ambiental y de seguridad. Algunos compuestos, como ciertos sales y ácidos, pueden ser corrosivos o tóxicos en altas concentraciones. La gestión adecuada de estos materiales y la implementación de medidas de seguridad en su manejo son cruciales para prevenir riesgos para la salud y el medio ambiente.
Conclusión
Los compuestos iónicos son fundamentales en la química debido a sus propiedades distintivas y su amplia gama de aplicaciones. Su estructura cristalina, alta dureza, y capacidad para conducir electricidad en estado fundido o en solución los hacen únicos en el ámbito de los compuestos químicos. Comprender estas características no solo ayuda en la identificación y uso de estos compuestos, sino que también permite una apreciación más profunda de su papel en la ciencia y en la vida cotidiana.